Les effets de la PR sur les poumons
Les poumons peuvent être affectés dans la PR par la PR elle-même ou par le traitement administré pour la PR.
Il existe trois situations dans lesquelles les poumons peuvent être affectés chez les personnes atteintes de polyarthrite rhumatoïde :
- Un effet direct de la maladie rhumatoïde sur les poumons
- Un effet indésirable du traitement administré contre les rhumatoïdes sur le tissu pulmonaire
- Infections thoraciques, conséquence de la rhumatoïde elle-même ou des traitements immunosuppresseurs administrés pour la traiter, provoquant une détérioration supplémentaire de la fonction pulmonaire
Cet article vise à donner un aperçu de ces trois manières dont les poumons peuvent être affectés.
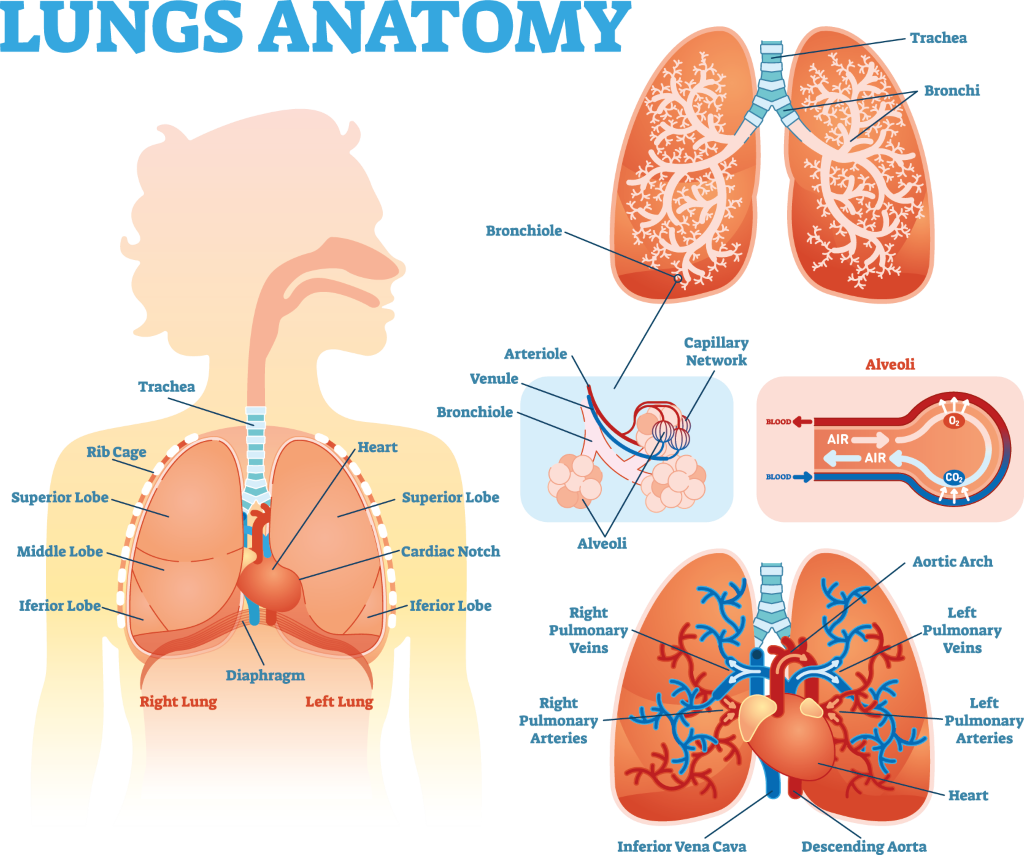
1. Les effets directs de la maladie rhumatoïde sur le tissu pulmonaire et la plèvre
Les personnes atteintes de PR peuvent développer une maladie des poumons, en raison de l'attaque de leur système immunitaire sur leurs articulations et d'autres tissus. Différents types de maladies pulmonaires peuvent survenir, notamment la maladie pulmonaire interstitielle (MPI), la bronchectasie et la bronchiolite oblitérante. Dans chacun de ces cas, une inflammation et des dommages peuvent survenir au niveau du tissu pulmonaire, réduisant la capacité d'absorber l'oxygène de l'air que nous respirons dans la circulation sanguine et provoquant un essoufflement chez les personnes affectées. Cela s'accompagne souvent d'une toux persistante, surtout à l'effort. Des tests respiratoires (également appelés tests de la fonction pulmonaire ou tests de la fonction pulmonaire) et un scanner des poumons sont utilisés pour confirmer le diagnostic, et des schémas précis de maladie pulmonaire sont décrits.
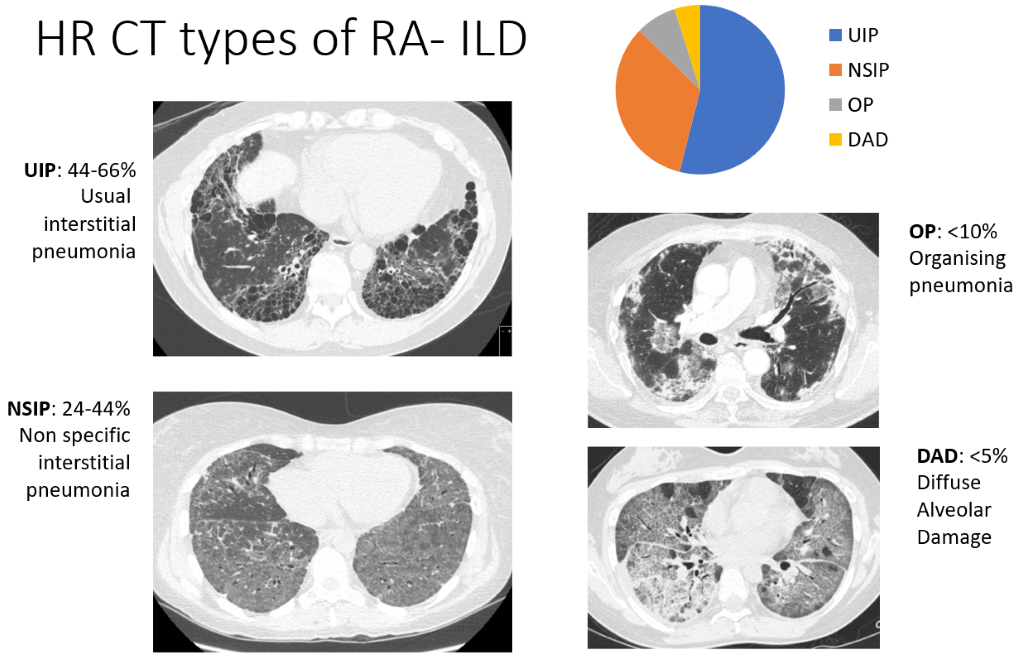
Maladie pulmonaire interstitielle (MPI)
Dans la maladie pulmonaire interstitielle (MPI), les cellules immunitaires s'accumulent dans les poumons, accompagnées d'un épaississement ou d'une fibrose des tissus. Cela signifie que les sacs aériens (alvéoles) sont moins capables d’absorber l’oxygène que nous respirons dans le sang. Bien que les tomodensitogrammes montrent des signes d'ILD chez une forte proportion de patients atteints de PR (plus de la moitié dans certaines études), ceux-ci ne sont pas suffisamment étendus pour provoquer un essoufflement ou une toux chez la plupart, les symptômes étant estimés chez aussi peu que 5 % des patients atteints de PR. Les aspects tomodensitométriques sont si caractéristiques que les radiologues sont capables de décrire quatre types d'ILD, répertoriés ci-dessous par ordre de fréquence :
- pneumonie interstitielle (UIP) – la forme la plus courante
- pneumonie interstitielle non spécifique (NSIP)
- pneumonie organisée (OP) et lésions alvéolaires diffuses (DAD) – beaucoup moins fréquentes
Les patients atteints de PR qui sont plus susceptibles de développer une PID comprennent :
- ceux qui ont fumé
- avez des nodules rhumatoïdes
- développé une PR à un âge relativement plus avancé
- avez un facteur rhumatoïde et des anticorps anti-CCP
- sont des hommes
Habituellement, l'ILD se développe plusieurs années après le diagnostic de PR, mais jusqu'à un quart des patients atteints de PR souffrent d'ILD à partir du moment où ils développent la PR pour la première fois, ou même avant que leurs articulations ne soient affectées. Historiquement, il n'existait aucun traitement contre la PID et la survie était faible, celle-ci étant la deuxième cause de décès prématuré (après les problèmes cardiovasculaires tels que les crises cardiaques et les accidents vasculaires cérébraux) chez les personnes atteintes de PR. Cependant, davantage d’aide est désormais disponible et il est prouvé que certains traitements, notamment le mycophénolate mofétil, le rituximab et l’abatacept, ralentissent, voire empêchent la progression de la PID.
Bronchectasie
La bronchectasie est une affection dans laquelle les branches des voies respiratoires sont élargies. Cela peut se produire à la suite d’infections récurrentes ou parce qu’elles sont séparées de la fibrose, comme cela se produit dans l’ILD. La conséquence est que le mucus et les sécrétions s’accumulent dans les voies respiratoires au lieu d’être crachés. La rétention des sécrétions est un problème car elle réduit le flux d'air et donc l'absorption d'oxygène, rendant la personne affectée essoufflée à l'effort. Les sécrétions retenues favorisent également la croissance des bactéries, ce qui rend les infections pulmonaires plus probables et, dans les cas les plus étendus, celles-ci deviennent un problème récurrent. Comme dans la PID, les caractéristiques sont plus fréquemment observées au scanner que celles signalées par les patients, avec jusqu'à 30 % présentant des zones de bronchectasie, mais beaucoup moins présentant des symptômes. Il existe certaines théories de la poule et de l'œuf concernant la bronchectasie et la PR, selon lesquelles les bactéries responsables de la bronchectasie sont une cause des anticorps CCP qui déclenchent ensuite l'apparition de la PR, et alternativement, la suppression immunitaire utilisée pour traiter la PR conduit à des infections pulmonaires récurrentes qui finissent par aboutir. dans les bronchectasies.
Bronchiolite oblitérante
La bronchiolite oblitérante est une autre maladie inflammatoire dans laquelle les plus petites voies respiratoires (bronchioles) sont bloquées ou obstruées. Cela signifie qu’il y a moins de flux d’air vers les sacs aériens et donc moins d’absorption d’oxygène. La personne affectée se sent essoufflée et peut avoir une toux et une respiration sifflante. Cette condition est plus souvent observée à la suite de l'inhalation de produits chimiques, tels que le diacétyle utilisé comme arôme dans le pop-corn micro-ondes et les cigarettes électroniques, mais peut rarement également survenir chez les personnes atteintes de PR. Contrairement à l’ILD, les symptômes peuvent apparaître sur une courte période, s’aggraver rapidement et, en l’absence de traitement réversible, les cas les plus graves peuvent nécessiter une transplantation pulmonaire.
La plèvre est une enveloppe à double couche entourant les poumons. Chez certaines personnes atteintes de PR, les couches pleurales peuvent être affectées par une inflammation, entraînant un épaississement du tissu pleural et une accumulation de liquide dans l'espace pleural. Cela est plus susceptible de se produire chez les hommes et les personnes atteintes de nodules rhumatoïdes. Un épaississement pleural et du liquide peuvent survenir autour d'un ou des deux poumons, et bien qu'il y ait des signes de ceci chez plus de la moitié de tous les patients atteints de PR au scanner, dans la majorité, l'étendue est légère et bien moins de 10 % présentent des douleurs ou un essoufflement pleural. maladie. Souvent, des investigations doivent être effectuées pour confirmer le diagnostic, nécessitant un prélèvement de liquide et une biopsie pleurale pour distinguer le liquide pleural rhumatoïde d'une infection (bactérie ou tuberculose) ou d'un cancer. Les traitements standard de la PR sont généralement efficaces pour la maladie pleurale et une intervention chirurgicale n'est que très rarement nécessaire pour empêcher la collecte de liquide.
Les nodules sont une caractéristique de la PR et peuvent apparaître dans les poumons ou sur la plèvre. Il s'agit d'un ensemble de cellules immunitaires, souvent trouvées à l'arrière du coude, et bien qu'elles soient le signe d'une hyperactivité du système immunitaire (ce qui fait partie du processus de la PR), les nodules eux-mêmes provoquent rarement des symptômes et ne causent généralement aucun dommage. Lorsqu’elles sont présentes dans le poumon, elles peuvent être solitaires ou multiples et leur taille varie de quelques millimètres à plusieurs centimètres lorsqu’elles sont visibles sur une radiographie pulmonaire. Bien qu'ils présentent certaines caractéristiques sur les tomodensitogrammes et les TEP, une biopsie (petit échantillon de tissu) doit parfois être prélevée pour confirmer le diagnostic, car ils peuvent ressembler à un cancer. Le traitement au méthotrexate peut rendre les nodules rhumatoïdes plus gros et plus nombreux, alors que d'autres thérapies, notamment le rituximab et les inhibiteurs de JAK, sont efficaces pour les réduire.
2. Les effets du traitement de la PR sur le tissu pulmonaire ou la plèvre
En principe, tout médicament qui supprime efficacement les processus inflammatoires d’origine immunitaire à l’origine de la PR devrait également être efficace contre toutes les manifestations de la maladie, dans tous les organes. Cela est généralement vrai, dans de nombreux cas dans lesquels les premiers signes de maladie pulmonaire ou pleurale au scanner ne progressent jamais au point que la personne affectée devient essoufflée ou développe une toux, en raison de l'efficacité des médicaments qu'elle prend. Néanmoins, lorsque l’on constate une aggravation de la PR pulmonaire, il peut être difficile de décider si c’est parce que le traitement existant n’est pas complètement efficace pour supprimer le processus inflammatoire de la PR ou bien parce que le traitement lui-même a un effet toxique direct sur les poumons. ou un effet indirect dû à des infections pulmonaires.
Le méthotrexate (MTX) est l'un des médicaments antirhumatismaux modificateurs de la maladie (ARMM) les plus importants utilisés pour traiter la PR. Elle est très rarement associée à une réaction allergique pulmonaire, appelée pneumopathie d’hypersensibilité (chez moins de 1 % des personnes). Cela survient souvent tôt, bien au cours de la première année de traitement, mais peut être retardé jusqu'à 3 ans après le début du traitement. Les patients se sentent malades en quelques jours, avec essoufflement, fièvre et malaises. L'arrêt du MTX et l'administration de stéroïdes à forte dose pendant une courte période suffisent pour que la majorité des cas se rétablissent. Cependant, comme la pneumopathie d'hypersensibilité peut être grave, voire mettre la vie en danger, les personnes atteintes d'une maladie pulmonaire préexistante (telle que la BPCO) ne commencent pas à prendre du MTX si l'on estime qu'elles pourraient ne pas survivre à une pneumopathie au MTX si elle survenait. En dehors de cette réaction et de la possibilité d'une augmentation des nodules rhumatoïdes, il n'existe aucune preuve que le MTX rende plus probable l'apparition d'autres complications pulmonaires associées à la PR, telles que la PID, et qu'au contraire, il pourrait avoir un effet protecteur en traitant de manière aussi efficace. le processus sous-jacent de la PR.
La sulfasalazine a été associée à un syndrome de type lupique caractérisé par une maladie pleurale, ainsi qu'à une pneumonie d'hypersensibilité « éosinophile ». Ce ne sont pas des événements courants et sont généralement réversibles après l’arrêt du traitement.
Le léflunomide a été très rarement associé au développement de l’ILD, en particulier chez les Asiatiques.
Les premiers rapports sur les inhibiteurs du TNF (TNFi) suggéraient un lien avec une PID progressive et la mort. Cependant, il a été difficile de déterminer si ce lien était dû aux médicaments, car les TNFi étaient initialement administrés à des personnes atteintes d'une PID sévère et avancée présentant un risque élevé d'infections pulmonaires et une faible probabilité de survie. Il n'a pas été démontré que cette classe d'agents biologiques provoque une PID chez les personnes atteintes d'autres maladies immunitaires, non associées en elles-mêmes à une maladie pulmonaire (par exemple, psoriasis, colite), mais la prudence est toujours de mise lors du traitement chez un patient présentant une maladie pulmonaire grave et un risque élevé de une infection pulmonaire sous thérapie biologique.
Actuellement, le rituximab , l'abatacept et le mycophénolate mofétil sont les options privilégiées par rapport aux anti-TNF, en partie en raison d'un risque légèrement plus faible d'infections pulmonaires.
4. Infections thoraciques
Les personnes atteintes de PR et de maladies pulmonaires ont plusieurs raisons de courir un risque accru d'infections pulmonaires (bronchite et pneumonie). Premièrement, parce que le poumon est endommagé, les défenses naturelles contre l’infection sont réduites. Cette situation est aggravée chez les personnes qui fument ou sont exposées à des fumées ou à d’autres toxines pulmonaires, et tous les efforts doivent être déployés pour arrêter de fumer. Cela s’ajoute au fait que fumer réduit l’efficacité des DMARD et des TNFi. Deuxièmement, les traitements contre la PR (tous les DMARD et les produits biologiques) agissent en supprimant le système immunitaire. Ce faisant, ils réduisent les défenses de l’organisme contre les infections et augmentent ainsi le risque d’infections. En outre, un cycle indésirable peut se développer dans lequel les DMARD et les thérapies biologiques doivent être interrompus pour permettre la guérison des infections pulmonaires, ce qui entraîne à son tour une poussée de PR et de maladie pulmonaire, entraînant davantage de lésions pulmonaires et une susceptibilité encore plus grande à l'infection. .
Il faut trouver un équilibre entre le risque d’infection et le traitement du processus rhumatoïde sous-jacent. Les mesures utiles consistent notamment à éviter tout contact avec des sources d'infection telles que les espaces bondés, à se tenir à jour des vaccins (grippe chaque année, vaccin antipneumococcique polysaccharidique PPV une fois) et à faire des exercices respiratoires pour faciliter l'élimination naturelle des sécrétions pulmonaires. Arrêter de fumer est très important.
Bien que tous les DMARD et thérapies biologiques comportent un risque accru d'infection, il devient de plus en plus clair que les stéroïdes (prednisolone) présentent le plus grand risque de tous, et tous les efforts doivent être faits pour arrêter le traitement par stéroïdes oraux (prednisolone) chez les personnes atteintes de maladie pulmonaire rhumatoïde. .
Mise à jour : 29/10/2019